- Autor Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:34.
- Modificat ultima dată 2025-01-23 12:43.
Diluarea este procesul de diluare a unei soluții concentrate. Există o varietate de motive pentru care cineva ar putea dori să facă o diluare, variind de la motive serioase la motive simple. De exemplu, biochimiștii diluează soluțiile din formele lor concentrate pentru a face soluții noi pentru utilizare în experimente, în timp ce, pe de altă parte, barmanii deseori diluează lichiorul cu băuturi răcoritoare sau sucuri pentru a face cocktailurile mai gustoase. Formula generală pentru calcularea diluției este C1V1 = C2V2, cu C1 și C2 reprezintă concentrațiile inițiale și finale ale soluției și respectiv V1 și V2 reprezintă volumul.
Etapa
Metoda 1 din 2: Diluarea exactă a concentratelor prin intermediul ecuației de diluare

Pasul 1. Determinați ceea ce știți și nu știți
Diluarea în chimie înseamnă de obicei luarea unei cantități mici dintr-o soluție din care cunoașteți concentrația, apoi adăugarea unui lichid neutru (cum ar fi apa) pentru a face o soluție nouă cu un volum mai mare, dar cu o concentrație mai mică. Acest lucru se face foarte des în laboratoarele de chimie, deoarece, din motive de eficacitate, reactivii sunt adesea depozitați în concentrații foarte mari, care sunt apoi diluați pentru utilizare în experimente. De obicei, în cele mai multe situații din lumea reală, veți cunoaște concentrația soluției inițiale și concentrația sau volumul pe care doriți să fie concentrația finală, dar nu volumul soluției inițiale de care aveți nevoie pentru a obține soluția finală.
- Cu toate acestea, în alte situații (în special în problemele școlare), poate fi necesar să găsiți alte piese ale puzzle-ului - de exemplu, vi se poate da un volum și o concentrație inițiale, apoi vi se va cere să găsiți concentrația finală dacă diluați o soluție. la volumul dorit. În orice caz de diluare, este util să se noteze variabilele cunoscute și necunoscute înainte de a începe.
-
Să terminăm exemplul de întrebări. Să presupunem că ni se cere să diluăm o soluție de 5 M cu apă pentru a obține 1 L dintr-o soluție de 1 mM. În acest caz, cunoaștem concentrația soluției noastre inițiale și volumul și concentrația finală pe care le dorim, dar nu cantitatea de soluție inițială pe care trebuie să o adăugăm cu apă pentru a obține rezultatul dorit.
Memento: În chimie, M este o măsurare a concentrației numită Molaritate, care denotă aluniții unei substanțe pe litru
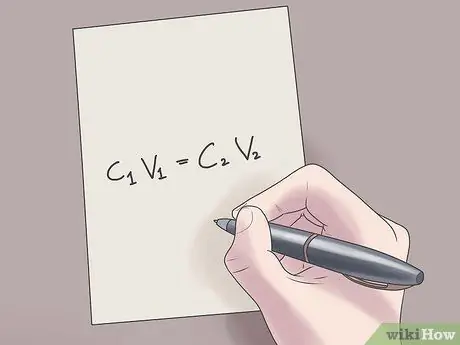
Pasul 2. Conectați valorile la formula C1V1 = C2V2.
În această formulă, C1 este concentrația inițială a soluției, V1 este volumul soluției inițiale, C2 este concentrația finală a soluției și V2 este volumul soluției finale. Conectarea valorilor cunoscute în această ecuație vă va ajuta să găsiți valori necunoscute cu dificultăți mai mici.
- S-ar putea să vă fie de ajutor să puneți un semn de întrebare în fața unității pe care doriți să o căutați pentru a vă ajuta să o rezolvați.
-
Să continuăm exemplul nostru. Vom introduce valorile pe care le cunoaștem după cum urmează:
- C1V1 = C2V2
- (5 M) V1 = (1 mM) (1 L). Cele două concentrații ale noastre au unități diferite. Să ne oprim aici și să trecem la pasul următor.

Pasul 3. Luați în considerare orice diferență de unitate
Deoarece soluțiile implică modificări ale concentrației (care uneori pot fi destul de mari), nu este neobișnuit ca cele două variabile din ecuația dvs. să aibă unități diferite. Deși acest lucru este ușor de trecut cu vederea, unitățile inegale din ecuația dvs. pot face ca răspunsul dvs. să fie incorect. Înainte de finalizare, convertiți toate valorile cu diferite unități de concentrație și / sau volum.
-
În exemplul nostru, folosim diferite unități pentru concentrațiile de M (molari) și mM (milimolari). Să schimbăm a doua noastră măsurare la M:
- 1 mM × 1 M / 1.000 mM
- = 0,001 M

Pasul 4. Terminați
Odată ce toate unitățile sunt egale, rezolvați ecuația. Acest lucru se poate face aproape întotdeauna cu algebră simplă.
-
Ne oprim aici problema de exemplu: (5 M) V1 = (1 mM) (1 L). Să găsim valoarea lui V1 cu noua noastră unitate.
- (5 M) V1 = (0,001 M) (1 L)
- V1 = (0,001 M) (1 L) / (5 M).
-
V1 = 0,0002 L sau 0,2 ml.

Pasul 5. Înțelegeți cum să utilizați corect răspunsul
Să presupunem că ți-ai găsit valoarea lipsă, dar nu ești sigur cum să folosești aceste informații noi în diluarea reală pe care trebuie să o faci. Acest lucru este de înțeles - limbajul matematicii și științei uneori nu se potrivește cu lumea reală. Când cunoașteți cele patru valori din ecuația C1V1 = C2V2, efectuați diluarea după cum urmează:
- Măsurați volumul V1 dintr-o soluție cu o concentrație de C1. Apoi, adăugați suficient diluant (apă etc.) pentru a face volumul total V2. Această nouă soluție va avea concentrația dorită (C2).
- În exemplul nostru, de exemplu, măsurăm mai întâi 0,2 mL dintr-o soluție de 5 M. Apoi, vom adăuga suficientă apă pentru a crește volumul soluției la 1 L: 1 L - 0,0002 L = 0,9998 L, sau 999, 8 mL. Cu alte cuvinte, vom adăuga 999,8 ml de apă la soluția noastră de probă mică. Noua noastră soluție diluată are o concentrație de 1 mM, care este concentrația noastră dorită.
Metoda 2 din 2: Realizarea unei soluții de diluare simple și practice

Pasul 1. Citiți orice ambalaj pentru informații
Există o varietate de motive pentru care ați putea dori să faceți o soluție de diluare acasă, în bucătărie sau în alt laborator non-chimic. De exemplu, prepararea sucului de portocale dintr-un concentrat simplu este o diluție. În multe cazuri, produsul care trebuie diluat conține informații despre diluarea care trebuie făcută, undeva pe ambalaj. Este posibil să aibă instrucțiuni precise de urmat. Iată câteva lucruri pe care trebuie să le căutați atunci când căutați informații:
- Volumul produsului utilizat
- Volumul diluantului utilizat
- Tipul de diluant utilizat (de obicei apă)
- Instrucțiuni speciale de amestecare
- Este posibil să nu vedeți informații despre concentrația exactă a lichidului utilizat. Aceste informații nu sunt utile consumatorului mediu.

Pasul 2. Adăugați substanța care acționează ca diluant la soluția concentrată
Pentru diluții simple de uz casnic, cum ar fi cele pe care le-ați putea face în bucătărie, trebuie să cunoașteți doar volumul de concentrat pe care îl utilizați și concentrația finală aproximativă dorită înainte de a începe. Diluați concentratul cu o cantitate adecvată de diluant, care se determină în funcție de volumul concentratului inițial utilizat. Vezi mai jos:
- De exemplu, dacă am dori să diluăm 1 cană de suc de portocale concentrat la 1/4 din concentrația sa inițială, am adăuga 3 cani apă în concentrat. Amestecul nostru final va avea 1 cană de concentrat în 4 cani de lichid întreg - 1/4 din concentrația sa inițială.
- Iată un exemplu mai complicat: dacă am dori să diluăm 2/3 cană de concentrat la 1/4 concentrația inițială, am adăuga 2 cani de apă, deoarece 2/3 cană este egal cu 1/4 ori 2 & 2/3 cană din lichid întreg.
- Asigurați-vă că adăugați substanța într-un recipient suficient de mare pentru a menține volumul final dorit - un castron mare sau un recipient similar.

Pasul 3. Ignorați volumul pulberii în majoritatea cazurilor
Adăugarea unei pulberi (cum ar fi anumite amestecuri de băuturi) la un lichid nu este de obicei considerată o diluție. Schimbarea volumului rezultată din adăugarea unei cantități mici de pulbere în lichid este de obicei suficient de mică pentru a fi neglijabilă. Cu alte cuvinte, atunci când adăugați o cantitate mică de pulbere la un lichid, adăugați pulberea la volumul final de lichid dorit și amestecați.
Avertizare
- Respectați toate instrucțiunile de siguranță furnizate de producător sau solicitate de compania dumneavoastră. Acest lucru este deosebit de important dacă trebuie să diluați soluția acidă.
- Lucrul cu soluții acide poate necesita măsuri și instrucțiuni de siguranță mai detaliate decât în cazul soluțiilor neacide.






